本文作者——
丁文裴 医渡科技创新医学与真实世界研究咨询顾问
谢 丽 医渡科技创新医学与真实世界研究高级副总裁
一款罕见病药物从实验室到患者,平均需要14年、耗资26亿美元——这是一场与时间的赛跑,更是与数据稀缺的博弈[1]。在全球8000多种罕见病中,仅有5%有药可医。中国《第二批罕见病目录》纳入的86种疾病中,近半数面临“境外有药、境内无药”的困境[2]。在这一背景下,真实世界数据正逐渐显现其破解困局的关键价值。
医渡科技将其专业的真实世界研究服务贯穿于药物研发的价值链条,从早期探索到后期评价实现关键赋能,以深度的行业实践,持续推动罕见病药物从研发到落地的全程加速。
困局:罕见病药物研发的“三重门”
罕见病药物研发面临着独特的科学和操作挑战,这些挑战相互关联,构成了研发道路上的三大核心困局。
自然史研究不足制约研发基础是首要难题。研究表明,71.9%的罕见病缺乏完整的自然病史研究,疾病进展轨迹不明确导致终点指标难以确定[3]。对疾病自然发展历程的了解不足,直接影响到临床试验设计的科学性和疗效评价的可靠性。许多罕见病由于患者数量稀少且分布分散,难以开展系统的前瞻性观察研究,导致基础流行病学数据和疾病进展数据的严重缺失。
诊断延迟和患者识别难题构成了第二重障碍。罕见病患者确诊之路充满艰辛,从症状出现到明确诊断平均需要4-7年时间,超过一半的患者需要辗转5家以上医疗机构[4]。这种普遍的诊断延迟不仅延误了患者的治疗时机,也使得临床试验的患者招募变得异常困难。当患者最终获得确诊时,可能已经错过了最佳的干预窗口,或者因为疾病进展而不再符合临床试验的入组标准。
传统临床试验的局限性是第三重挑战。在罕见病领域,实施传统的随机对照试验面临着伦理和方法学的双重困境。当疾病危及生命且缺乏有效治疗时,设置安慰剂对照存在伦理争议;而患者数量的稀少也使得大样本随机试验难以开展。数据显示,约72%的罕见病临床试验因招募不足而被迫延长或终止[4],单个患者的临床试验成本是常见病的3-5倍[5]。
这三重困局相互交织,形成了一个复杂的挑战网络,需要有创新的研发范式来突破现有局限,而真实世界证据正好为此提供了可行的解决方案。
破局:真实世界证据打开药物研发新路径
在全球范围内,监管机构正在为真实世界证据开辟“绿色通道”。美国FDA在过去三年间基于真实世界证据支持的罕见病药物批准数量显著增长,显示出对这一新型证据来源的日益重视。
中国国家药监局也发布了《真实世界证据支持药物研发与审评指导原则》,为真实世界证据在药物研发中的应用提供了明确的政策指引。欧洲药品管理局同样设立了“真实世界证据专项工作组”,致力于加速真实世界证据向监管决策的转化。
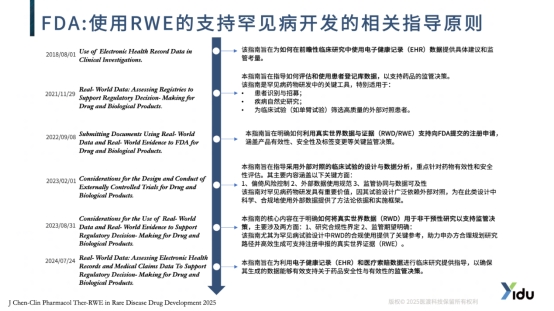
真实世界数据通过整合多源医疗信息,为罕见病研究提供了全新的视角。基于电子健康记录、医保数据、患者登记等来源的真实世界数据,能够有效补充传统临床试验的不足。这些数据不仅能够反映真实诊疗环境下患者的疾病历程和治疗效果,还能为药物研发提供关键的基线信息和外部对照。
技术进步正在重塑罕见病药物研发的范式。数据治理和分析方法的创新,使得从分散的医疗数据中提取高质量的科研证据成为可能。通过构建标准化的数据模型和先进的分析流程,研究人员能够更准确地描述疾病特征、识别潜在患者并评估治疗价值。
实践:真实世界数据驱动罕见病研发方法论
案例一:发作性睡病自然史研究,填补中国人群证据空白
发作性睡病作为一种罕见的慢性神经系统疾病,全球患病率估计为每10万人30.6至69.4例,然而中国人群的流行病学数据长期缺失。针对这一证据空白,医渡科技助力企业开展了一项基于真实世界电子健康记录(EHR)数据的回顾性队列研究。
该研究利用覆盖1600万人口的区域医疗数据库,系统分析了发作性睡病在中国人群中的患病率、发病率及临床特征。研究首次揭示了中国发作性睡病患者的诊断路径、治疗模式及疾病负担,为临床试验设计提供了关键的基线数据。通过分析70多家医院的医疗记录,研究发现发作性睡病患者从症状出现到确诊平均需要5-10年,凸显了诊断延迟的严重性。
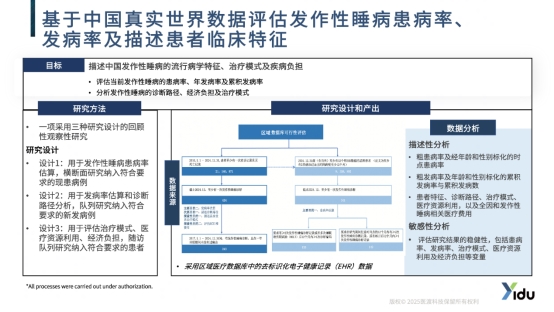
这项研究的价值在于首次建立了中国发作性睡病的自然病史profile,为未来临床试验的终点选择、患者分层和外部对照构建提供了本土化证据基础。研究发现的独特临床特征,也为针对中国人群的个性化治疗开发指明了方向。
案例二:ROSAH综合征预测模型,破解超罕见病患者识别难题
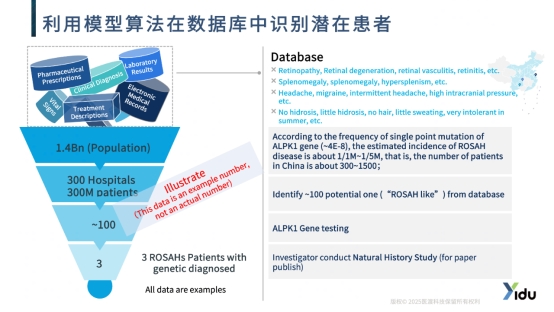
ROSAH综合征是一种由ALPK1基因突变引起的超罕见病,全球确诊病例不足100例[6]。由于患者极度分散且临床表现复杂多样,传统的患者识别方法面临巨大挑战。
针对这一难题,医渡科技助力药企创新性地构建了ROSAH综合征临床表型谱及基因突变谱预测模型。基于ALPK1基因T237M位点的突变频率(约千万分之二至六),预估中国ROSAH患者约为240-840例。研究通过整合患者的眼部病变、脾大、关节痛、自身免疫异常等多系统症状数据,建立了精准的表型-基因型关联模型。
该模型通过算法在医疗数据库中自动识别具有相似表型特征的“疑似患者”,大大提高了患者识别的效率。这种方法使得研究人员能够从海量数据中精准筛选潜在患者,为后续的自然史研究、临床试验入组和靶向治疗开发奠定了患者基础。这一创新方法为其他超罕见病的研究提供了可复制的技术路径。
案例三:那西妥单抗外部对照研究,加速创新疗法获批
在高危神经母细胞瘤(HR-NB)的治疗领域,那西妥单抗的获批历程展示了真实世界数据在支持监管决策中的关键作用。根据FDA公开的审评资料,由于在这种致命性疾病中进行随机安慰剂对照试验存在伦理困境,申办方采用了单臂试验结合外部对照的研究设计。
研究汇集了两项开放标签、单臂试验的数据,所有入组的复发/难治性HR-NB患者都接受那西妥单抗治疗。结果显示,那西妥单抗组的客观缓解率(ORR)达到45%,部分缓解患者的中位缓解持续时间(DoR)为6.2个月。
这一案例的关键突破在于利用真实世界数据构建的外部对照组。根据FDA的审评报告,研究人员从历史临床试验和大型癌症中心的真实世界数据库中,筛选出与试验组患者基线特征相似的对照组,采用倾向评分匹配等统计方法确保组间可比性。分析显示,外部对照组的ORR仅为-10%,与那西妥单抗组形成的显著差异为疗效评价提供了有力证据。
基于这一真实世界证据,那西妥单抗于2020年11月获得美国FDA加速批准[7],2024年进入中国市场,为HR-NB患者提供了新的治疗选择。这一案例充分证明,在传统随机对照试验难以实施的情况下,精心设计的真实世界研究可以作为有效的补充证据,为创新疗法开辟了新的审评与可及路径。
随着技术的不断发展,真实世界证据的价值正在向更多领域延伸:支撑医保决策、知道临床实践、赋能患者管理,推动个性化治疗,也在重构罕见病药物研发全价值链。这些源于真实临床的数据,不仅能缩短药物研发进程,更重要的是通过提供贴近临床实践的证据,确保研发方向更精准地满足患者需求。
当AI技术与生命关怀相遇,真实世界证据不再仅仅是冰冷的数字,而是化为温暖的希望。每一次严谨的分析,都在为宝贵生命争取宝贵的时间。
参考文献
[1] Yang G, et al. The national economic burden of rare disease in the United States in 2019. Orphanet J Rare Dis. 2022.
[2] 2025《中国罕见病行业趋势观察报告》
[3] Nguengang Wakap S, et al. Estimating cumulative point prevalence of rare diseases: analysis of the Orphanet database. Eur J Hum Genet. 2020.
[4] 中国罕见病联盟. 罕见病药物临床试验现状调查报告. 2023.
[5] J Chen. Clin Pharmacol Ther-Challenges and Strategies in Rare Disease Drug development. 2025.
[6] Williams LB, et al. ALPK1 missense pathogenic variant in five families leads to ROSAH syndrome. Genet Med. 2019.
[7] FDA. Summary Review of Naxitamab. 2023.
